采用阵列式光源-探测器探头的检测方案可以对腹部出血信息进行初步诊断,并且可以简单判定出血区域的位置。近红外光在腹部的检测深度为48mm,因此对于浅层腹部出血有较好的检测灵敏度。
以下为本篇论文正文:
摘要 目的 针对腹部闭合性损伤和腹部出血诊断的困难,近红外光谱技术是一种无创伤、无污染的腹部出血检测的新方法。方法采用Monte Carlo方法 仿真近红外光场分布模型。首先,建立了腹部多层组织的生物学模型。然后,为探究腹腔体液和血液对光子的吸收情况,对正常腹部和腹部出血时的光强信号进行了仿真模拟。通过探究光源和探测器间距不同时的光强分布来确定腹部出血位置。同时,为确定出血量对检测信号的影响和近红外光在腹部的检测深度,还对出血体积和检测深度的规律进行探究。结果 在模拟腹腔体液和血液对光子吸收时,二者对光子的吸收有较大区别。出血位置的仿真结果表明,当出血位置在光源和探测器连线的中心位置靠光源侧时检测深度最深。近红外光在腹部的检测深度为48mm.在一定范围内,光强信号与出血体积成反比。结论 近红外光谱技术可以实现对浅层腹部出血进行检测,并且具有较好的灵敏度。
关键词 MonteCarlo仿真;近红外光谱;腹部检测;检测深度;阵列式分布
0引言
腹部创伤失血以及由此导致的休克是现代战伤的主要死亡原因[1],也是现代社会年轻人的主要死亡原因之一[2].腹部创伤可分为开放性和闭合性损伤。由于闭合性损伤体表没有伤口,损伤部位比较隐蔽,因此临床诊断非常困难。此外腹部战伤的死亡率与伤后至确诊的时间有紧密关系,伤后2h内获得正确治疗者90%可望治愈,但随着时间的延迟死亡率明显增加[3].如果不能在早期确定内脏是否受损,很可能因贻误手术时机而导致严重后果[4],因此,要降低伤亡率就需要尽力缩短诊断时间。但是,在大多数情况下,由于时间、地点、设备等的限制,腹部创伤伤员难以得到及时的诊断和治疗,因此,迫切需要一种实时、快速、准确、便捷的腹部检测方法。腹部损伤常用的检测方法有腹腔穿刺术、B超、CT、X射线、腹腔镜、血管造影等。腹腔穿刺术是最简捷、安全和多次使用的有效方法,但由于穿刺时间、部位、患者个体差异,仍存在假阳性的可能[5].B超诊断无创迅速、操作简便、费用低,对于脏器损伤和腹部积液诊断阳性率高,但受肠腔积气及检查者经验水平的影响容易发生漏诊[6].CT诊断可反映损伤部位程度和性质,比B超更客观、准确、假阳性少,但是对实质脏器损伤或患者不配合时容易发生漏诊[7].目前,B超和CT及多手段联合检查是临床诊断的主要方向。腹部损伤及腹部出血大多涉及内脏损伤,临床表现复杂多样且损伤部位隐蔽,给临床诊断带来很大的困难,往往容易发生漏诊、误诊。一些患者病情变化迅速,繁琐的诊断方式也容易造成患者错过最佳的治疗时机。
近红外光谱技术是一种新兴的无损检测方法,它具有无创、无污染、实时检测等优点,已被广泛应用于各个领域。近红外光具有较强的穿透能力,其穿透深度可达数个厘米。当用近红外光照射生物组织时,由于组织对光子的吸收和散射,出射光会携带大量的组织内部信息。因此,可以通过检测不同的出射光强信号来对组织内部信息进行提取,然后进行分析和诊断。
目前,采用近红外光谱技术在闭合式腹部损伤的研究还处于探索阶段。光子在腹部多层组织的穿透深度和腹部检测灵敏度等问题还亟待进一步探究。本文主要采用MonteCarlo模拟的方法,仿真近红外光在腹部的光场分布模型,并对相关参数进行了初步探究。通过仿真近红外光在腹部模型的检测情况,旨在提出一种新型的腹部出血检测方法,为采用近红外光谱技术检测腹部出血打下基础。
1检测原理及仿真模型
1.1检测原理
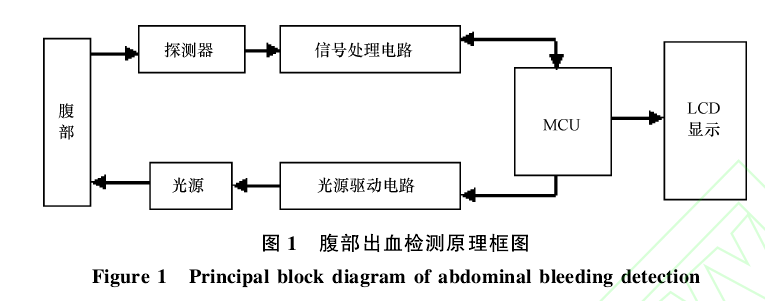
光与生物组织的相互作用主要表现为组织对光子的吸收和散射。吸收是指光照射到待测物体时,部分光能转换成热运动或者吸收介质分子的某种振动,从而导致光强的衰减[8].生物组织中的吸光物质有血红蛋白、肌球素、脂类和细胞色素等。散射是由于各层组织的密度、折射率、介电常数等存在差异[9-11].由于体液和血液对光子的吸收不同,光在照射到正常腹部和有积血的腹部时,其检测到的光强信号也会有所差别。因此,可以采用近红外光谱技术对腹部出血进行检测,其检测原理见图1.
在图1中,微控制器(microprocessor control unit,MCU)通过光源驱动电路控制光源的时序(多光源)和发光频率。光源发出的光子经过腹部组织的吸收、散射等作用后,部分出射光被探测器接收。探测器检测到的光强信号经过信号处理电路的转换、滤波、放大等处理后,传输至MCU进行存储和分析。最后MCU将处理后的信息送至LCD显示。
1.2Monte Carlo仿真流程
本文采用哈佛大学编写的模拟仿真复杂组织光场分布的tMCimg软件[12],对腹部组织进行仿真和计算分析。然后通过检测相应位置的光强信号来判断腹部的出血情况。仿真过程及操作流程如下:
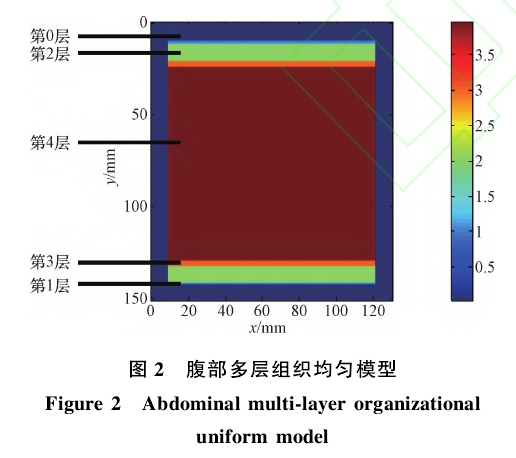
首先,建立腹部多层组织的仿真模型(见图2);
然后,设置各层组织的光学参数(见表1)及仿真光子数N=106;
最后,确定光源和探测器的位置及方向,按照设定的步骤进行仿真。其中tMCimg软件既可以跟踪所有光子,也可以对特定位置的光子进行追踪。腹部出血的近红外光场分布模型仿真
在用MonteCarlo方法模拟光束照射到腹部组织模型的光场分布时,生物组织可以用下面的参量来描述:折射率n、吸收系数μa、散射系数μs以及各向异性因子g[13].同时,还需要对各层组织的厚度进行合理设置。
1.2.1腹部组织模型
人体的腹部组织比较复杂,仿真时将其简化为一个立方体模型(150mm×130mm×180mm)。由于腹部组织的非均一性,所以在对腹部进行检测时需要考虑不同组织对检测信号的影响。腹部组织的具体划分如图2所示。
图2为仿真模型的一个截面。腹部仿真模型从外到内依次可划分为4层:皮肤层1、脂肪层2、肌肉层3和模拟腹腔内部的体液层4(第0层为空气层)。
仿真时,光源与探测器位于腹部组织的同侧并紧贴皮肤层的表面,方向由表皮指向腹腔内部。光源和探测器的位置可以通过给仿真模型建立坐标系,由相应坐标来设定。腹部各层组织的光学参数[14-15]和厚度[16]设置如表1所示。
1.2.2腹部组织的仿真参数
(1)体液和血液:在对腹部进行检测时,需要明确体液和血液对光子的吸收情况。首先,固定光源和探测器的位置,仅改变仿真模型中的第4层,即全部为血液和全部为体液。然后检测腹部的出射光强信号。
(2)出血位置:采用单光源多探测器方案,首先固定光源和探测器的位置,设定皮肤层下30mm处有积血,积血区域(设为球体)半径为15mm.改变积血区域(中心位置)和光源的水平距离依次为5mm、15mm、25mm、35mm、45mm,然后对出射光强信号进行检测。
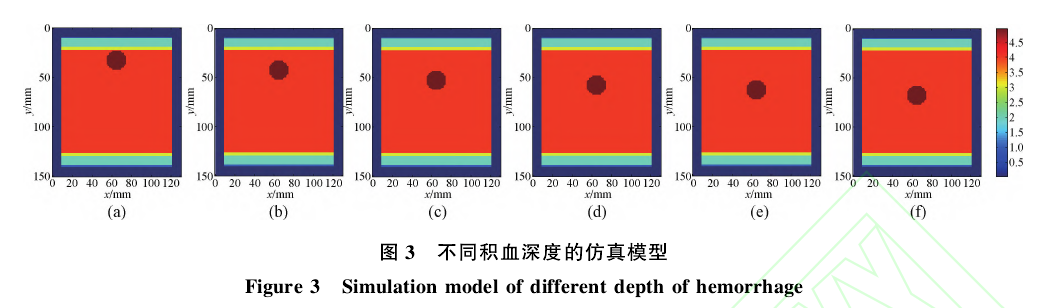
(3)检测深度:检测深度是腹部检测的一个重要参数。首先,固定光源和探测器的间距为40mm,积血区域半径为10mm,球心的位置在光源和探测器连线的中垂线上。改变积血区域的深度,即积血区域的中心位置在皮肤层下的深度,然后观察检测到的光强信号。如图3所示,(a)~(f)表示出血深度依次为23mm、33mm、43mm、48mm、53mm、58mm时的情况。
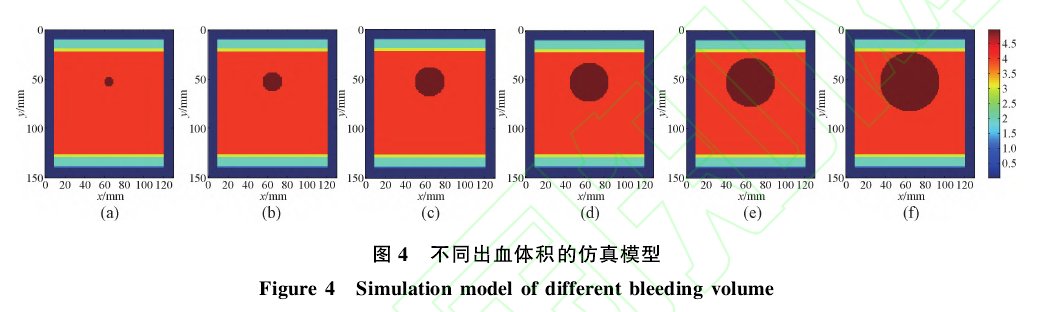
(4)出血体积:首先,固定光源和探测器的间距为60mm,出血位置在其几何连线的中垂线上,出血深度设定为皮下43mm.改变出血区域的半径,观察不同出血量时所检测到的光强信号。如图4所示,(a)~(f)依次为出血深度和位置相同时,出血区域半径为5mm、10mm、15mm、20mm、25mm、30mm时的情况。
2仿真结果及分析
2.1腹部检测中体液和血液对光子的吸收
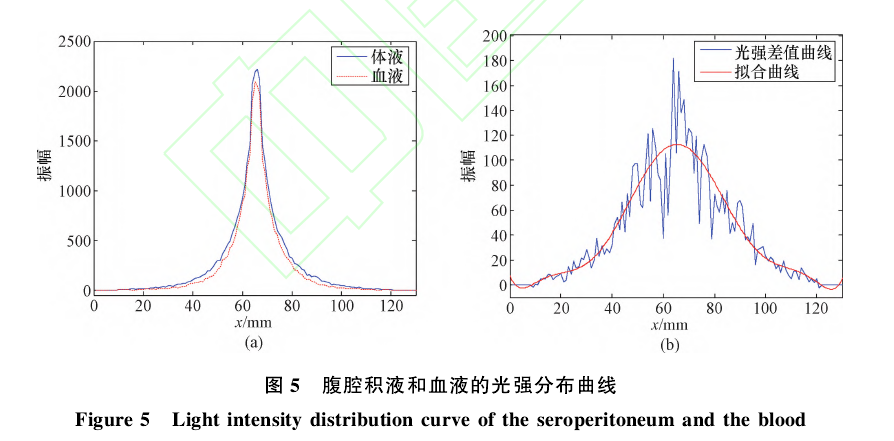
取光源坐标为(65,10,70),改变腹部模型中的第4层(体液层):全部为血液和全部为体液,然后对腹部模型中第70层(即皮肤层表面且和光源在同一直线上,该直线和x轴平行)的出射光强信号进行检测。所测得的光强分布曲线如图5所示。
在图5中,(a)为腹腔内部全部为体液和全部为血液时所检测到的光强分布曲线;(b)为上述两个模型中,相同位置上检测到的光强差值曲线及其拟合曲线。从图5(a)可以看出,体液和血液对光子的吸收有明显差别,因此可以通过检测腹部的出射光强信号来判断腹部是否有积血。由图5(b)可知,在35mm~95mm(即探测器和光源的间距为0~30mm)范围内都可以检测到较大差别的光强信号。
2.2出血位置的确定
光源和3个探测器连线的垂直距离为50mm,皮肤层下30mm处有积血,改变出血区域(中心位置)和光源的水平距离依次为5mm、15mm、25mm、35mm、45mm,其仿真结果如图6所示。其中光源和探测器的坐标分别为:光源(65,10,60),探测器1(60,10,110),探测器2(65,10,110),探测器3(70,10,110)。
由图6可以看出,出血位置(出血区域中心)与光源的水平距离为15mm时,检测到的光强幅值最小。当二者间距大于或者小于15mm时,检测的光强幅值均有增加。由此可知,当出血位置在光源和探测器几何连线的中垂线并靠近光源一侧时,光子被吸收的概率最大,检测效果最好。
2.3近红外光在腹部的检测深度
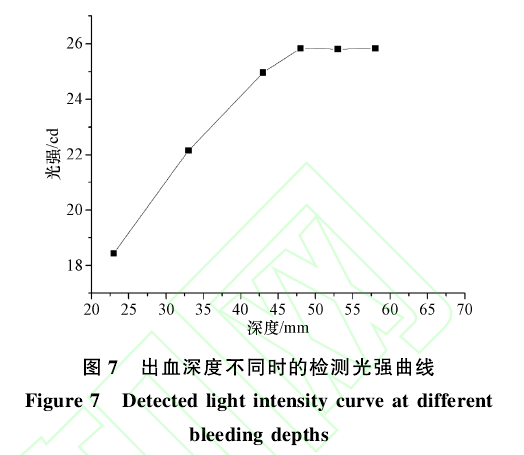
光源和探测器的坐标分别为:光源(65,10,40),探测器(60,10,80),改变出血区域深度依次为23mm、33mm、43mm、48mm、53mm、58mm,所检测到的光强信号曲线如图7所示。
在图7中,可以看出随着出血深度的增加检测到的光强幅值逐渐增大。当出血深度大于48mm时,检测到不同深度的光强幅值几乎没有变化。这说明,随着出血深度的增加,光子被吸收的概率逐渐减小。当深度大于48mm时,检测到的光强信号已不能反映腹部的出血信息。
2.4一定范围内出血体积和检测光强成反比关系
光源和探测器的坐标分别为:光源(65,10,30),探测器(60,10,90),改变出血区域半径(出血体积)依次为5mm、10mm、15mm、20mm、25mm、30mm,观察不同出血量时所检测到的光强信号。仿真结果如图8所示。
从图8可以看出,随着出血体积的增加检测到的光强幅值依次减小。这说明,积血量(出血体积)越大,光子被吸收的概率越大,所检测到的光强幅值就越小。
3模拟结果分析及探测器探头改进
论文首先建立了腹部多层组织的生物模型,然后采用MonteCarlo方法对光在腹部复杂组织中的光场分布进行了仿真模拟。结果表明,可以根据体液和血液对光的不同吸收来对腹部的出血情况进行检测,并且在光源和探测器连线的中心位置靠光源侧的检测深度最深。腹部最大检测深度为48mm.一定范围内,随着出血体积的增加,检测的光强信号逐渐减弱。
但是,人体腹部组织比较复杂,损伤部位很难确定,单一的光源-探测器检测很难对出血区域进行精确的定位和判断。为了获得腹部出血及损伤区域的详细信息,采用阵列式光源-探测器分布的检测方案,以便对腹部出血信息进行真实呈现。探头设计、操作流程及仿真结果如下。
3.1阵列式光源-探测器探头设计
阵列式光源-探测器探头由12个光源和6个探测器组成,如图9所示。其中12个光源采用4×3组合,相邻光源的间距为2cm,6个探测器按图中所示位置进行放置,每个探测器与其相邻的4个光源等间距分布。
3.2阵列式光源-探测器模型
在用阵列式光源-探测器探头对腹部进行检测时,首先将探头固定于皮肤层表面(由光源和探测器的坐标来确定),然后设置模拟腹部出血区域的位置:探测器D4的正下方(区域1);光源S6、S7和探测器D2、D5所围四边形的中心位置处(区域2),出血区域直径为20mm,深度设为30mm.
当区域1有积血时,给定一个光源的光强,检测6个探测器的信号值,然后给定下一个光源的光强,检测6个探测器的信号值,最后将每个探测器所检测到的12个信号值分别相加,所得值作为最终的光强幅值。当区域2有积血时,操作步骤亦然。
3.3阵列式光源-探测器方法可初步确定腹部积血区域的位置
采用阵列式光源-探测器探头对腹部不同出血区域进行检测,仿真结果如图10和表2所示。
从表2可以看出,当区域1有出血时,6个探测器所检测到的光强幅值均不相同。和腹部正常时所检测到的光强信号相比,D3和D6检测到的光强信号前后基本没有变化,差值比较大的为D4、D5、D2、D1.因此可初步判定在D4、D5、D2、D1所围区域内有积血。这和实际出血区域位置略有偏差。当区域2有出血时,只有D1检测到的光强幅值在腹部正常时略小于腹部有出血时的情况。检测到的光强幅值前后差值比较大的为D2、D5、D4、D3.由此可初步判断在D2、D5、D4、D3所围区域内有积血。这和实际出血区域位置基本一致。图10为正常腹部和在区域1、区域2分别有积血时所检测到的光强差值柱状图。
4讨论与结论
通过上述分析,可以看出阵列式光源-探测器可以很好地检测腹部的出血信息,并能够对积血区域的位置进行初步判定。在实际操作中,可以:①对正常腹部的检测情况作一标定,设置合理的阈值范围;②采用合适的重建算法,重现腹部的出血情况;③合理设计光源和探测器的数量,增强图像的分辨率;④改变探测器和光源的组合方式,实现对腹部出血信息的精确判定。
近红外光谱技术可以实现对腹部出血的简便、快速、无创检测。采用阵列式光源-探测器探头的检测方案可以对腹部出血信息进行初步诊断,并且可以简单判定出血区域的位置。近红外光在腹部的检测深度为48mm,因此对于浅层腹部出血有较好的检测灵敏度。近红外光谱技术,由于其具有便捷、快速、准确的特点,可以应用于战时环境下对腹部损伤伤员的检测和诊断。
参考文献
[1] Champion H, Bellamy RF, Roberts CP, et al. A profile ofcombat injury[J]. The Journal of Trauma, 2003, 54(5) : S13-19.
[2] Demetriades D, Murray J, Charalambides K, et a1. Traumafatalities: time and location of hospital deaths[J]. Journal of theAmerican College of Surgeons, 2004, 198(1):20-26.
[3]甄玉英,甄鹰,程军。战时腹部外伤的急救及护理观察要点[J].空军总医院学报, 2005, 21(3): 178-179.Zhen Yuying, Zhen Ying, Cheng Jun. Abdominal traumaemergency treatment and nursing observation points in war time[J]. Journal of General Hospital of Air Force, PLA,2005,21(3):178-179.
[4]岳茂兴。腹部枪弹伤的特点及救治对策[J].伤残医学杂志,2002,10(3):25-28.Yue Maoxing. Characteristics and treatment of abdominal bulletwound counter measures [J]. Medical Journal of Trauma andDisability,2002,10(3):25-28.
[5]赵胜,潘振龙,张三荣,等。腹部闭合性损伤早期诊断的难点及对策[J].吉林医学, 2013, 34(13):2442-2445.Zhao Sheng, Pan Zhenlong, Zhang Sanrong, et al. Diagnosisdifficulties and countermeasures of blunt abdominal injury [J].Jilin Medical Journal,2013,34(13):2442-2445.
[6]宗立永,寇会玲。 B超和CT在腹部闭合性损伤诊断中的应用[J].临床和实验医学杂志, 2010,9(2):149.
[7] Federle MP, Jeffrey RB. Hemoperitoneum studied by computedtomography[J]. Radiology, 1983, 148:187-192.
[8]缪辉。基于近红外连续波的无创组织体血氧监测系统[D].天津:天津大学,2005.Miao Hui. Noninvasive tissue oxygen saturation detection systembased on continuous wave near infrared spectroscopy [D].Tianjin:Tianjin University,2005.
[9]苏畅,丁海曙,白净。生物组织光谱技术[J].国外医学生物医学工程分册,1995,18(6):316-323.Su Chang, Ding Haishu, Bai Jing. Biological tissue spectroscopy[ J ]. Foreign Medical Sciences: Biomedical EngineeringFascicle,1995,18(6):316-323.
[10] Gary Strangman, David A Boas, Jeffrey P Sutton. Non-invasive neuroimaging using near-infrared light [J]. Biol Psychiatry,2002,52:679-693.
[11]谌雅琴。生物组织化学成分无创分光检测基本传感理论的研究[D].天津:天津大学,2005.Shen Yaqin. A study on basic transduction theory for noninvasivemeasurement of tissue components using spectroscopy [D].Tianjin: Tianjin University, 2005.
[12] Boas D, Culver J, Stott J, et al.Three dimensional Monte Carlocode for photon migration through complex heterogeneous mediaincluding the adult human head[J]. Optics Express, 2002, 10(3) : 159-170.
[13]王雪娜,李韪韬,钱志余,等。大鼠创伤性脑水肿模型中近红外光有效检测深度研究[J].光子学报, 2011, 40( 2):278-279.
Wang Xuena, Li Weitao, Qian Zhiyu, et al. Near infraredeffective detection depth in mouse traumatic brain edma model[J]. Acta Photonica Sinica, 2011, 40(2):278-279.
[14] Cheong WF, Prahl SA, Welch AJ. A review of the opticalproperties of biological tissues [J]. IEEE Journal of QuantumElectronics, 1991, 26(12): 2166-2185.
[15] Graaf R, Dassel AC, Koelink MH, et al. Optical properties ofhuman dermis in vitro and in vivo[J]. Applied Optics, 1993, 32(4): 435-447.
[16]丁海曙,王峰,林方,等。在多层结构的生物组织中近红外光子迁移的研究[J].光谱学与光谱分析, 2001, 21(2):157-158.Ding Haishu, Wang Feng, Lin Fang, et al. Research on thenear?infrared (NIR) photon migration in multi?layered structuresof biological tissues [J]. Spectroscopy and Spectral Analysis,2001, 21(2):157-158.