在热处理(43℃,15min)后6h能够建立稳定的热应激诱导的睾丸生殖细胞凋亡模型,不仅证明了短暂低热对男性生殖健康的影响,并可为进一步探明热诱导的睾丸生殖细胞凋亡分子机制、最终为临床治疗男性不育和指导男性生殖保健提供理论依据。
以下为本篇论文正文:
【摘要】目的 探讨单次、短暂、轻度阴囊热处理(43℃,15min)对小鼠睾丸的损害作用。方法 24只成年ICR雄性小鼠,随机分为4组。将热处理组小鼠身体的下1/3部分浸于43℃恒温水浴中15min,于热处理后0.5h、2h和6h取睾丸组织。将对照组小鼠下腹部浸入22℃水浴15min,6h后处死取睾丸组织。采用HE染色对睾丸组织进行病理学检查,采用TUNEL方法检测细胞凋亡,采用western blotting检测睾丸caspase-3蛋白表达。结果 热处理后6h小鼠睾丸组织生精小管间隙增大,生精小管内细胞排列紊乱,胞浆空泡化明显,核固缩细胞增多,多核精细胞显着增加。与阴性对照组相比,阴囊热处理能够显着诱导小鼠睾丸生殖细胞凋亡,增加睾丸组织裂解型caspase-3蛋白的表达。结论 单次、短暂、轻度阴囊热处理(43℃,15min)能够明显引起睾丸病理组织学损伤,诱导睾丸生殖细胞凋亡。
【关键词】应激;生殖细胞;动物实验
随着全球环境、人们生活习惯的改变,近40~50年来,男性的精液质量明显下降,男性不育症的发病率逐步上升。然而,人们多关注环境污染物及感染等因素对男性生殖的影响[1,2],而对环境温度升高及生活方式改变对男性生殖发育的影响不是非常重视。并有研究认为,长期桑拿浴可能使机体适应类似急性运动所引起的代谢热应激,对机体的免疫功能具有保护作用[3];而坐浴目前也是医学上常用的一种治疗方法,在一盆温度适宜(41~43℃)的水中坐浴15~20min,有利于男性生殖健康[4].这些研究没有认识到高温对男性生殖的损害作用。本课题将小鼠下腹部浸于43℃恒温水浴中15min,主要探讨单次、短暂、轻度热处理对小鼠睾丸组织病理的影响,为探讨高温对男性生殖的损害作用提供参考依据。
1材料与方法
1.1实验动物 健康清洁级ICR小鼠(6~8周龄,雄性,28~35g)购自安徽省实验动物中心[实验动物合格证号为SCXK(皖)2011-002].实验前将所有小鼠于常规条件下适应性喂养1周。本课题所有动物实验均得到安徽医科大学实验动物伦理委员会批准并严格按照《中华人民共和国实验动物管理条例》进行。
1.2化学试剂 原位末端缺口标记细胞凋亡检测(TdT-mediated dUTP nick end labeling,TUNEL)试剂盒购于Promega公司。聚偏二氟乙烯(polyvinyli-dene fluoride,PVDF)膜购于Millipore公司。β-肌动蛋白(β-actin)抗体购自北京博奥森公司;caspase-3抗体购自Cell Signaling Technology公司。其它未特殊说明的试剂均购自Sigma公司。
1.3动物处理 24只成年雄性ICR小鼠,被随机分为4组。将热处理组小鼠身体的下1/3部分浸于43℃恒温水浴中15min,分别于热应激后0.5h、2h和6h取睾丸组织。将对照组小鼠下腹部浸入22℃水浴中15min,6h后剖杀,留取睾丸组织。
1.4睾丸组织HE切片 取小鼠一侧睾丸,置于4%改良Davidson's固定液中固定。每组分别制备不同小鼠HE染色切片,在光学显微镜下观察睾丸组织病理学变化并拍照。
1.5TUNEL 每组分别制备不同小鼠睾丸组织石蜡切片,采用TUNEL方法检测细胞凋亡。经染色后凋亡细胞核被染成深综色或深褐色。在光学显微镜下观察细胞凋亡情况并拍照。
1.6蛋白质免疫印迹(Western blotting) 提取睾丸蛋白,进行蛋白质印迹检测。转移有蛋白的PVDF膜在4℃过夜封闭后分别用一抗(β-actin:1∶1000、caspase3:1∶1000)室温孵育2~3h.PBST洗膜后再用辣根过氧化物酶标记的的山羊抗兔IgG(β-actin:1∶40000;caspase3:1∶30000)室温孵育2h,采用增强化学发光试剂盒进行发光检测、压片后分析。
1.7统计分析 所有计量资料采用x±s来表示,采用SPSS17.0统计软件进行统计学分析。多组间比较采用方差齐性检验和单因素方差分析分析各组之间差异是否有统计学意义。检验水准α=0.05.
2结果
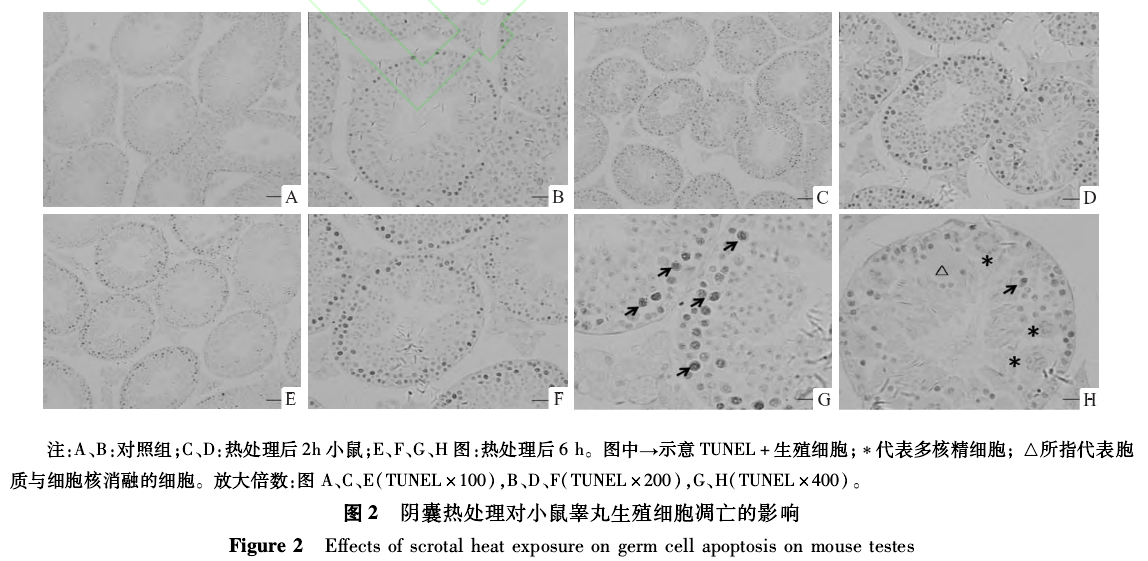
2.1热处理对小鼠睾丸组织病理的影响 对照组小鼠睾丸内生精小管内细胞排列紧密,层次较清晰,见图1A、D.与对照组比较,单次、短暂、轻度阴囊热处理所引起的睾丸损伤非常明显,热应激处理2h后睾丸生殖细胞细胞核固缩,见图1B、E,而热处理后6h病理改变进一步加重,表现为睾丸组织生精小管间隙增大,生精小管内细胞排列紊乱,胞浆空泡化明显,核固缩细胞增多,见图1C、F、G.此外,在阴性对照组生精小管内几乎不含多核精细胞(multinucleate spermatogenic cells,MSCs),热处理后2h组睾丸多核精细胞略有增加,而在热处理后6h组睾丸多核精细胞显着增加,且在大多数多核细胞内染色质呈环状分布或聚集在细胞中央,其大小不等,核多少不一,见图1C、H、I.在热处理后6h组甚至可见细胞质及核消失的一些生殖细胞,见图1H、I.
2.2热诱导睾丸生殖细胞凋亡 结果显示,对照组TUNEL+生殖细胞很少,见图2A、C,在热处理后2h睾丸TUNEL+生殖细胞明显增多,见图2B、D.而热处理后6hTUNEL+生殖细胞进一步增多,且TUNEL+细胞主要为精原细胞和初级精母细胞,见图2E、F、G、H.然而,未见TUNEL+的多核精细胞,见图2H.
2.3热处理对小鼠睾丸caspase-3蛋白表达的影响 Caspase-3为凋亡信号传导通路中关键的执行分子。本研究进一步采用westernblot技术分析pro-caspase-3及激活型caspase-3的表达。结果发现,单次、短暂、轻度阴囊热处理能够增加睾丸激活型caspase-3蛋白表达水平,并具有时间效应关系,见表1,证实单次热处理能够诱导睾丸生殖细胞凋亡,见图3.
3讨论
随着全球气候的变暖、温室效应的加重、一些地区高温时间的延长及生活方式的转变等将人们越来越频繁的置于高温环境中。高温环境不仅直接导致中暑、热射病等热致疾病发生,更诱导或加速了多种重大疾病的发生发展,严重危害人类的健康,甚至危及生命[5].然而环境温度升高及生活方式改变对睾丸温度和功能的影响并未受到充分的重视。精子发生是一个温度依赖的过程,阴囊温度升高可干扰精子发生和最终导致不育[6-8].近年来的研究表明,拥有正常精子的调查对象,如果每周2次桑拿,连续3个月,能够诱导显着改变精子参数和线粒体功能,引起精子DNA组装异常,最终损害精子发生[7,8].
本研究首先探讨了单次、短暂、轻度热处理对小鼠睾丸组织病理的影响,在实验中所采用的温度(43℃)与进行中药坐浴所选择的最适温度相当,并明显低于洗桑拿浴干蒸时的温度。研究结果显示,将小鼠下腹部浸于43℃恒温水浴中15min,能够引起明显的睾丸病理损伤,其病理改变主要表现为:热处理组睾丸组织生精小管间隙增大,生精小管内细胞排列紊乱,支持细胞大空泡和凋亡细胞明显增多。此外,热处理后睾丸多核精细胞显着增加。
多核精细胞是热诱导睾丸组织损伤的一个非常典型的病理改变。某些干扰睾丸生精过程的化学物质(如苯、三氯苯咪唑)及锌缺乏等也能够使生精上皮出现多核精细胞[9-11].以往的研究发现,将阴囊浸于43℃恒温水浴30min,在处理后1d、3d曲细精管内多核细胞明显增多[12].而本研究表明,在单次、短暂、轻度热处理后6h即能够明显引起睾丸组织出现多核精细胞。一些研究认为异常环境所形成的多核细胞,是属于机体组织一种抗损伤的遗传性防御反应。然而目前对多核细胞的研究较少,对其形成机理及生物学意义尚需进一步探讨。
细胞凋亡是细胞在一定条件下接受刺激信号并受基因调控的一种自主性、程序性死亡过程。动物实验研究也证实,哺乳动物睾丸暴露在腹腔温度或高于腹腔温度均可诱导阶段特异性生殖细胞凋亡。本研究采用TUNEL方法进一步证实单次、短暂、轻度阴囊热处理能够明显诱导睾丸生殖细胞凋亡,而且凋亡仅发生在睾丸的生精上皮,间质细胞很少有凋亡发生,这与前面的研究结果相一致[13,14].因此认为睾丸的生精上皮可能是对外来刺激最敏感的部位。此外,在本研究中并未发现有TUNEL+的多核精细胞。根据细胞形态推测,在热处理后6h组细胞质及核消失的生殖细胞可能由多核精细胞发展而来,提示多核精细胞的形成可能是热应激所引起的精子生成减少的另一种方式。
Caspase家族在介导细胞凋亡的过程中起着非常重要的作用,其中Caspase-3为关键的执行分子。Caspase-3正常以酶原(32KD)的形式存在于胞浆中,在凋亡的早期阶段被激活,活化的Caspase-3由两个大亚基(17KD)和两个小亚基(12KD)组成,裂解相应的胞浆胞核底物,最终导致细胞凋亡。本研究结果发现,热处理能够增加睾丸激活型caspase-3蛋白表达水平,并具有一定的时间效应关系,进一步证实单次、短暂、轻度阴囊热处理能够诱导睾丸生殖细胞凋亡。
综上所述,本研究发现单次、短暂、轻度阴囊热处理能够明显引起睾丸病理组织学损伤,诱导睾丸生殖细胞凋亡。在热处理(43℃,15min)后6h能够建立稳定的热应激诱导的睾丸生殖细胞凋亡模型,不仅证明了短暂低热对男性生殖健康的影响,并可为进一步探明热诱导的睾丸生殖细胞凋亡分子机制、最终为临床治疗男性不育和指导男性生殖保健提供理论依据。
参考文献
[1]Wilcox AJ,Bonde JP.On environmental threats to male infertility aa[J].Asian J Androl,2013,15(2):199-200.
[2]杨露露,王华,姬艳丽,等。细菌脂多糖急性暴露对小鼠睾丸组织的损害作用[J].中华疾病控制杂志,2015,19(2):166-169.
[3]陈小琼,肖国强。桑拿浴对人体力竭运动后外周血白细胞计数与分类的影响[J].体育研究与教育,2013,28(4):123-125.
[4]杨关云,王丽玉,何美玉,等。中药坐浴温度对混合痔术后疗效的影响[J].新中医,2013,45(8):69-70.
[5]Gasparrini A,Armstrong B.The impact of heat waves on mortality[J].Epidemiology,2011,22(1):68-73.
[6]Kanter M,Aktas C,Erboga M.Heat stress decreases testicular germ cell proliferation and increases apoptosis in short term:an immunohistochemical and ultrastructural study[J].Toxicol Ind Health,2013,29(2):99-113.
[7]Garolla A,Torino M,Sartini B,et al.Seminal and molecular evidence that sauna exposure affects human spermatogenesis[J].Hum Reprod,2013,28(4):877-885.
[8]Jurewicz J,Radwan M,Sobala W,et al.Lifestyle and semen quality:role of modifiable risk factors[J].Syst Biol Reprod Med,2014,60(1):43-51.
[9]Singh RK,Bansode FW.Benzene-induced histopathological changes and germ cell population dynamics in testes of Sprague Dawleyrats[J].J Environ Biol,2011,32(6):687-694.
[10]Toner E,Brennan GP,Hanna RE,et al.Fasciola hepatica:time-dependent disruption of spermatogenesis following in vivo treatment with triclabendazole[J].Parasitol Res,2011,109(4):1035-1043.
[11]Kumari D,Nair N,Bedwal RS.Effect of dietary zinc deficiency on testes of Wistar rats:Morphometric and cell quantification studies[J].JTrace Elem Med Biol,2011,25(1):47-53.
[12]许多,朱伟杰,王自能,等。热诱导大鼠睾丸生精上皮多核细胞的出现和变化[J].生殖与避孕,2005,25(4):201-204.
[13]Ji YL,Wang H,Zhao XF,et al.Crosstalk between endoplasmic reticulum stress and mitochondrial pathway mediates cadmium-induced germ cell apoptosis in testes[J].Toxicol Sci,2011,124(2):446-459.
[14]Kim J,Soh J.Cadmium-induced apoptosis is mediated by the translocation of AIF to the nucleus in rat testes[J].Toxicol Lett,2009,188(1):45-51.