摘要
为了测定牦牛 DDAH1和 DDAH2基因序列并比较其在牦牛和雄性不育犏牛睾丸中的表达,以探究该基因与犏牛雄性不育的联系,试验从牦牛睾丸中提取总 RNA,采用 RT-PCR技术克隆并测序获得牦牛 DDAH1和 DDAH2基因的 cDNA序列;利用实时荧光定量 RT-PCR技术检测这两个基因在牦牛与犏牛睾丸中的表达。结果表明:克隆获得的牦牛 DDAH1和 DDAH2基因序列分别长959bp及 1091bp,均包含 858bp的 CDS区。DDAH1基因序列与普通牛相比有 4个碱基差异,序列同源性为 99.58%,而推导的氨基酸序列仅存在 1个氨基酸残基差异;DDAH2基因序列与普通牛比较相差 1个碱基,序列同源性为 99.91%,推导的氨基酸序列存在 1个氨基酸残基差异。DDAH1和DDAH2基因在牦牛和犏牛睾丸组织中均有表达,DDAH1基因在犏牛睾丸组织中的表达量显着高于牦牛(P<0.05),是牦牛睾丸组织中表达量的 1.5倍;DDAH2基因在犏牛睾丸中的表达量与牦牛相比差异不显着。说明 DDAH基因表达在犏牛睾丸中上调可能与其雄性不育有关。
关键词:牦牛;杂交雄性不育;DDAH基因;基因克隆;睾丸
目录
摘要
关键词
1 材料与方法
2 结果
3 讨论
参考文献
牦牛(Bosgrunniens)是青藏高原的特有牛种,它们具有耐高寒低氧、耐粗放等优点,但其肉、乳等生产性能较低。牦牛与普通牛(Bostaurus)的杂交后代(犏牛)在生产性能上具有明显的杂种优势,然而犏牛表现出 F1到 F3代雄性不育,这极大限制了犏牛杂种优势的固定,是牦牛杂交改良的一大瓶颈。有关犏牛雄性不育现象已有科研工作者从精子减数分裂阻滞[1-2]、能量代谢[3]、DNA甲基化[4-5]、转录调控[6]等遗传基因以及组织解剖[7-8]方面着手展开研究,但是迄今犏牛雄性不育机制尚无明确的定论。对牦牛和犏牛睾丸蛋白质组学研究中发现,二甲基精氨酸 -二甲胺水解酶 (dimethylarginine dimethylaminohydrolase,DDAH)在犏牛与牦牛睾丸组织中的表达存在差异,推测 DDAH有可能通过 DDAH/ADMA/NOS途径[9]调节 NO的浓度进而影响犏牛睾丸组织中精子发生、精子获能、受精能力等,可能与犏牛雄性不育有关。
DDAH(EC3.5.3.18)是一种胞浆蛋白酶,包括DDAH1和 DDAH2两种亚型,主要水解代谢一氧化氮合酶(NOS)抑制物---非对称性二甲精氨酸(ADMA),在机体内 NOS催化 L-精氨酸生成 L-瓜氨酸和一氧化氮(NO),是催化生成 NO最主要的酶。C.T.Tran等[9]在培养的内皮细胞中发现,增加 DDAH抑制剂会导致 ADMA的积累,抑制了 NOS的活性,从而减少了 NO的生成,这表明 DDAH的活性或表达量对于 NO的生成起着重要的调控作用。有研究显示,低浓度的 NO可促进小鼠睾酮分泌[10],但过量的 NO对精子有毒害作用,影响精子活力和活率,增加不活动精子数量,且精子受毒害程度与 NO浓度成 正比[11].NOS和 NO参与了睾酮的分泌,在精子生成、受精及精子脂质过氧化反应等过程中起着重要调节作用,因此,DDAH对于 NO所参与的睾酮分泌的调控最终对于雄性生殖产生深远影响,可能是导致犏牛雄性不育的原因之一。本研究通过基因克隆的方法获得了牦牛 DDAH1及 DDAH2基因的完整编码区序列,并比较了牦牛与普通牛的基因序列及氨基酸序列,同时利用实时荧光定量 PCR方法分析了 DDAH1和 DDAH2基因在牦牛和犏牛睾丸组织中的 mRNA水平,以探索其在表达水平上与犏牛雄性不育的关联。
1 材料与方法
1.1 样品的采集
试验用成年牦牛(n=9)及犏牛(n=7)睾丸组织于秋季采自四川成都市青白江区屠宰场,采集后立即放入 液 氮 速 冻 后 带 回 实 验 室。所 有 样 品 均 置 于-80℃保存,待用。
1.2 DDAH1和 DDAH2基因的克隆测序
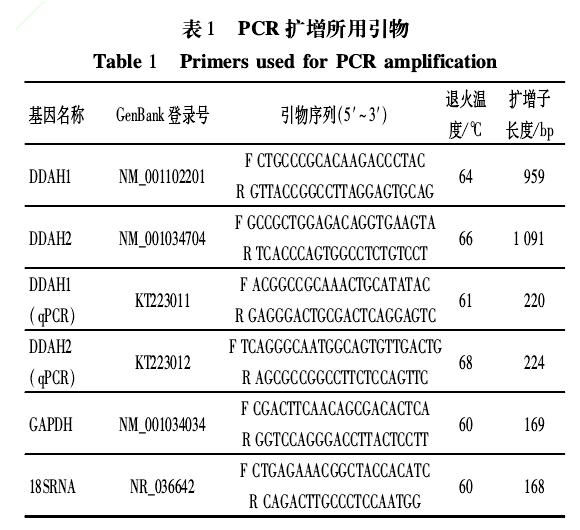
利用 TRIzol试剂(购自 Invitrogen公司)按照其产品操作说明从睾丸组织中提取总 RNA.采用 RevertAidTMFirstStrandcDNASynthesisKit(购自 Thermo公司)以牦牛总 RNA为模板、Oligo(dT)18为反转录引物进行反转录获得 cDNA第一链。根据已公布普通牛的 DDAH核酸序列(GenBank登录号见表 1),用PrimerPremier5.0软件在序列的 CDS区两侧设计PCR特异引物(见表 1)。以 cDNA为 PCR模板,扩增程序为:95℃预变性 4min;95℃变性 30s,引物退火 30s(温度见表 1),72℃延伸 90s,共 35个循环;72℃ 延 伸 8min.预 期 能 分 别 扩 增 出 包 含DDAH1和 DDAH2基因 CDS区在内长为 959bp和1091bp的 2个基因片段。PCR产物用 2.0%琼脂糖凝胶电泳进行检测。RT-PCR产物经纯化后依次连接到 pMD19-T载体(购自 TaKaRa公司)并转化至 DH5α宿主中进行克隆。抗氨苄重组筛选后挑选出 20个阳性单克隆进行扩大培养,经菌液 PCR鉴定后利用载体通用引物 M13F及 M13R进行双向测序,序列信息使用 BankIt工具提交至 GenBank.
1.3 牦牛 DDAH1及 DDAH2基因生物信息学分析
将所测序列在 NCBI数据库中使用 BLAST工具与野牦牛(Bosmutus)及普通牛序列进行同源性比对,并在该数据库中比对其编码的氨基酸序列。使用蛋白质性质在线分析软件 ProtParam(http://web.expasy.org/protparam/)对 DDAH1和 DDAH2基因编码的氨基酸序列基本性质进行预测。
1.4 牦牛及犏牛睾丸中 DDAH1和 DDAH2基因丰度的检测
采用实时荧光定量 PCR方法对牦牛及犏牛睾丸组织中的 DDAH1与 DDAH2基因 mRNA表达水平进行检测。根据克隆测序后的 cDNA序列以及普通牛内参基因 Gapdh、18SRNA序 列 信 息,借 助 PrimerPremier5.0软件分别设计定量 PCR特异引物(见表 1)。
提取的总 RNA经质检合格后,取 4μg利用上述试剂盒自带的随机六聚体引物 R6进行反转录合成cDNA作为定量模板。PCR反应体系(25μL):QuantiFastTMSYBRGreenPCR Mastermix(QIAGEN公司)12.5μL,上、下游引物各 1μL,模板 1μL,ddH2O9.5μL.PCR反应程序:95℃预变性 5min;95℃变性 15s,引物退火 20s(温度见表 1),72℃ 延伸 15s,共 40个循环。定量 PCR检测分为牦牛组和犏牛组,组内每个样品同时检测目的基因和 2个内参基因,每个基因设 3个平行重复。
1.5 数据的统计与分析
每个样品的检测结果利用 2个内参基因 Ct值的几何平均数对目的基因进行校正。牦牛和犏牛组间相对表达水平使用 2-△△Ct法[12]进行计算;数据用“平均值 ±标准差”表示,用 SPSS18.0软件对两组数据进行独立样本 t检验分析,P<0.05作为差异显着标准。
2 结果
2.1 牦牛 DDAH1和 DDAH2基因的克隆测序结果
对牦牛睾丸组织中 DDAH1和 DDAH2基因进行RT-PCR扩增,扩增产物经 2.0%琼脂糖凝胶电泳检测,获得特异的与预期大小相一致的 DNA片段(见图 1)。
克隆测序结果表明,两片段长度分别为 959bp以及 1091bp,均包含长 858bp的完整 CDS区,与普通牛 DDAH序列比对证实片段为牦牛 DDAH基因序列。
2.2 牦牛 DDAH1及 DDAH2基因的序列特征见图 2.
克隆所获牦牛 DDAH1基因(GenBank登录号为KT223011)序列长度为 959bp.该序列与预测野牦牛序列(XM_005888439)相似性为 100%;与普通牛序列(NM_001102201)相似性为 99.58%,存在 4个碱基差异,且差异碱基均位于 CDS区内,在 CDS区的第 333,375,390,777位碱基牦牛依次为 C、C、C、T,普通牛依次为 A、T、T、C.根据牦牛 DDAH1基因测序结果推导的氨基酸序列共包含 285个氨基酸,该序列与野牦牛氨基酸序列完全相同,与普通牛存在一个氨基酸差异,即第 111位氨基酸在牦牛序列中为 Asn,普通牛为 Lys(见图 2A)。
克隆牦牛 DDAH2基因(KT223012)序列总长度为 1 091 bp,其 与 预 测 野 牦 牛 的 序 列 (XM _005904203)相似性为 99.63%,有 4个碱基存在差异,其中 1个差异碱基位于 CDS区;与普通牛(NM_001034704)序列相似性为 99.91%,存在 1个碱基差异,该差异碱基就位于 CDS区。位于 CDS区的差异碱基皆在 CDS区的第 8位,在牦牛序列中为 A,野牦牛和普通牛中为 C.牦牛 DDAH2基因推导的氨基酸序列由 285个氨基酸组成,其与野牦牛及普通牛氨基酸序列存在一个氨基酸差异,牦牛的第 3位氨基酸为Lys,而野牦牛及普通牛皆为 Thr(见图 2B)。
ProtParam工具预测结果表明:牦牛 DDAH1基因编码的氨基酸序列分子质量为 31.27ku,预测等电点(pI)为 5.54;普通牛分子质量为 31.28ku,预测 pI为5.67,由于第 111位氨基酸差异导致了二者 pI的较大差异。牦牛 DDAH2基因推导的氨基酸序列预测分子质量为 29.80ku,预测 pI为 5.82;野牦牛与普通牛预测分子质量为 29.78ku,预测 pI为 5.66,牦牛与野牦牛及普通牛的第 3位 Lys与 Thr的差异导致了pI的明显差异。
2.3 牦牛和犏牛睾丸中 DDAH1和 DDAH2基因mRNA表达水平
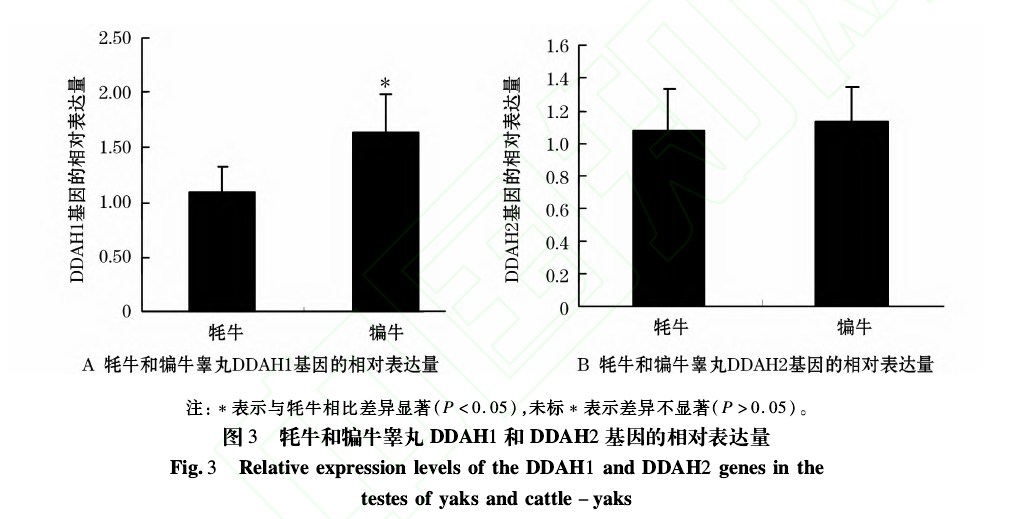
根据克隆获得 DDAH1及 DDAH2序列及内参基因信息设计特异定量引物(见表 1),定量 PCR扩增获得的熔解曲线峰形单一,扩增特异性好;所建立的所有基因标准曲线扩增效率均符合相应算法要求。定量 PCR结果表明:DDAH1和 DDAH2基因在牦牛和犏牛睾丸组织中均有表达,DDAH1基因在犏牛睾丸组织中的表达量显着高于牦牛(P<0.05),是牦牛睾丸表达量的 1.5倍(见图 3A);DDAH2基因在犏牛睾丸组织中的表达量与牦牛接近(见图 3B)。
3 讨论
研究通过基因克隆方法成功获得了牦牛睾丸组织 DDAH1和 DDAH2基 因 的 cDNA 序 列。牦 牛DDAH1基因 cDNA序列与野牦牛序列完全相同,表明在野牦牛的驯化进程中该基因具有高度的保守性。牦牛 DDAH1基因与普通牛存在 4个碱基差异且均位于 CDS区内,但其中 3个碱基差异并未引起氨基酸的变化,推测牛种间这种“同义突变”可能是调节蛋白质翻译效率以及稳定性的需要[13];另一个碱基的差异导致了氨基酸的变化,从 D.Frey等[14]对牛DDAH1基因的研究结果表明,该差异氨基酸并不位于 DDAH1酶的活性口袋也不在催化活性中心,因此牦牛与普通牛 DDAH1基因在功能上的差异可能不大,但 Asn与 Lys的电荷差异是否会引起蛋白酶空间结构的变化从而导致功能的差异尚待进一步研究。牦牛 DDAH2基因 cDNA序列与普通牛相差 1个碱基,该碱基差异导致了 DDAH2基因一个氨基酸的改变,但二者蛋白质的分子质量及 pI的差异并不明显,是否蛋白酶的功能有所差异尚需研究;与野牦牛相差的 4个碱基中的 3个位于 CDS区以外,这些碱基差异或许与 mRNA的稳定性以及转录后编辑过程有关[15].
荧光定量 PCR结果表明:DDAH1基因在犏牛睾丸组织中的相对表达量显着高于牦牛,相差约 1.5倍;DDAH2基因在犏牛睾丸组织中的丰度则与牦牛接近。而此前付伟等[16]鉴定牦牛与犏牛睾丸中的差异表达蛋白时发现犏牛睾丸中 DDAH2蛋白水平是牦牛睾丸中的 3倍,推测犏牛 DDAH2杂合基因序列与牦牛存在差异,这种差异可能导致其 mRNA在细胞中寿命延长从而翻译出较多数量的 DDAH2蛋白[17-18].从 DDAH/ADMA/NOS通路上看,犏牛睾丸组织中较高表达的 DDAH可将内源性 ADMA水解代谢,NOS抑制解除后其活性上调,从而催化产生过量的 NO,过量浓度的 NO不仅会破坏精子 DNA的完整性[19],而且对精子发生、精子获能、受精能力等过程造成严重损害,这可能是犏牛雄性不育的原因之一。J.Leiper等[20]发现增加 NO浓度会引起 DDAH活性降低,此后其通过抑制 DDAH的活性增加了 ADMA的积累,抑制 NOS活性,减少了 NO的生成[9],这表明 DDAH和 NOS活性之间存在着反馈调节,两者可能共同调节细胞内 NO的生成和释放。为了进一步研究 DDAH对犏牛与牦牛睾丸组织中 NOS及 NO的调节,阐明犏牛雄性不育与 DDAH的关联,下一步将检测犏牛睾丸组织中 NOS及 NO的含量,对犏牛睾丸 DDAH/ADMA/NOS通路进行深入探究。
参考文献:
[1] 金帅,郭宪,包鹏甲,等。牦牛和犏牛 Dmrt7基因序列分析及其在睾丸组织中的表达水平[J].中国农业科学,2013,46(5):1036-1043.
[2] 屈旭光,李齐发,刘振山,等。牦牛、犏牛睾丸组织中 SYCP3基因 mRNA表达水平研究[J].畜牧兽医学报,2008,39(8):1132-1136.
[3] 付伟,黄林,刘文静,等。牦牛和雄性不育犏牛睾丸 FABP5和FABP9基因 mRNA水平及能量代谢相关酶活力的比较[J].畜牧兽医学报,2015,46(4):561-567.
[4] GU Y,LI Q,PAN Z,et al.Molecula rcloning,gene expression and methylation status analysis of PIWIL1 in cattle-yaks and the parental generation[J].Anim ReprodSci,2013,140(3/4):131-137.
[5] LUO H,ZHOUY,LI Y,et al.Splice variants and promoter methylation status of the Bovine Vasa Homology(Bvh)gene may be involved in bull spermatogenesis[J].BMC Genet,2013,14:58.
[6] HUANG L,JIN S Y,XU Y O,et al.Quantitation of alternative splicing variants of lactate dehydrogenase C gene in testes of adult yak,sexually immature yak calf and sterile male hybrid of yak[J].Can J Ani Sci,2012,92(3):291-296.
[7] 张旭静。牦牛和普通牛种间杂种公牛睾丸的组织学观测与研究[J].畜牧兽医学报,2001,32(4):314-318.
[8] 卢建远,字向东。F1代犏牛睾丸的解剖组织结构研究[J].畜牧与兽医,2014,46(12):61-63.
[9] TRAN C T,LEIPER J M,VALLANCE P.The DDAH/ADMA/NOS pathway[J].Atheroscler Suppl,2003,4(4):33-40.
[10]VALENTI S,CUTTICA C M,FAZZUOLI L,et al.Biphasic effect of nitric oxide on testosterone and cyclic GMP production by purified rat Leydig cells cultured in vitro[J].Int J Androl,1999,22(5):336-341.
[11]ROSSELLI M,DUBEY R K,IMTHURN B,et al.Effects of nitric oxide on human spermatozoa:evidence that nitric oxide decreases sperm motility and induces sperm toxicity[J].Hum Reprod,1995,10(7):1786-1790.
[12]LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the2(-DeltaDeltaC(T))Method[J].Methods,2001,25(4):402-408.
[13]HUNT R C,SIMHADRI V L,IANDOLI M,et al.Exposing synonymous mutations[J].Trends Genet,2014,30(7):308-321.
[14]FREY D,BRAUN O,BRIAND C,et al.Structure of the mammalian NOS regulator dimethylarginine dimethylaminohydrolase:A basis for the design of specific inhibitors[J].Structure,2006,14(5):901-911.
[15]DU J,DUNGAN S Z,SABOUHANIAN A,et al.Selection on synonymous codons in mammalian rhodopsins:a possible role in optimizing translational processes[J].BMCEvolBiol,2014,14:96.
[16]付伟,李彩霞,刘文静,等。利用双向电泳 -质谱技术鉴定牦牛和犏牛睾丸中的差异表达蛋白质[J].西南民族大学学报(自然科学版),2014,40(1):11-15.
[17]MEHTA R,CHANDLER-BROWN D,RAMOS F J,et al.Regulation of mRNA translation as a conserved mechanism of longevity control[J].Adv Exp Med Biol,2010,694:14-29.
[18]KUWANO M,ONO M,ENDO H,et al.Gene affecting longevity of messenger RNA:a mutant of Escherichia coli with altered mRNA stability[J].Mol Gen Genet,1977,154(3):279-285.
[19]AMIRI I,SHEIKH N,NAJAFI R.Nitric oxide level in seminal plasma and its relation with sperm DNA damages[J].IranBiomedJ,2007,11(4):259-264.
[20]LEIPER J,MURRAY-RUST J,McDONALD N,et al.S-nitrosylation of dimethylarginine dimethylaminohydrolase regulates enzyme activity:further interactions between nitric oxide synthase and dimethylarginine dimethylaminohydrolase[J].PNAS,2002,99(21):13527-13532.